Как решать задачи по теме "Электрохимическая коррозия металлов"?
Для начала давайте разберемся, что такое электрохимическая коррозия.
Электрохимическая коррозия (гальванокоррозия) - процесс взаимодействия металла с коррозионной средой, сопровождающийся протеканием окислительно-восстановительных реакций (ОВР). Это самый распространенный вид коррозии.
ОВР - реакции, сопровождающиеся изменением степени окисления. Здесь существуют 2 процесса:
1. Окисление - процесс увеличения степени окисления.
2. Восстановление - процесс уменьшения степени окисления.
Таким образом, окислитель присоединяет электроны, а восстановитель отдает электроны.
Например:
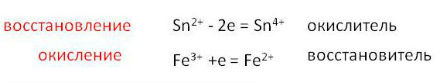 Условием протекания электрохимической коррозии является:
1. наличие раствора электролита
2. наличие двух сопряженных процессов - катодного и анодного.
Анодом (А) называется участок поверхности металла, с которого ионы переходят в раствор электролита. Анод заряжен отрицательно (-) и на нем протекает окислительный процесс разрушения металла.
Катод (К) - участок поверхности металла, где разряжаются катионы электролита. Катод заряжен положительно (+) и на нем протекает восстановительный процесс.
Таким образом, поверхность металлического изделия представляет собой совокупность катодных и анодных микроучастков, которые в среде электролита образуют короткозамкнутые гальванические элементы.
Во время работы гальванические элементы могут частично поляризоваться. В результате перехода электронов с анода на катод потенциал катода становится более отрицательным, а потенциал анода более положительным. В этом случае происходит явление выравнивания потенциалов, что вызывает прекращение тока и коррозии.
В электрохимии ключевым понятием является активность металла.
Активность металла характеризуется величиной стандартного потенциала металла.
Чем меньше величина стандартного потенциала металла, тем больше способность атомов металла, погруженного в раствор, отдавать электроны, т.е. тем больше его химическая активность.
В зависимости от величины стандартного потенциала металлы объединены в электрохимический ряд напряжений. Окислительная способность металлов увеличивается в этом ряду слева направо, а восстановительная способность металлов увеличивается справа налево. Чем левее находится металл в ряду напряжений (чем отрицательней значение его потенциала), тем выше его химическая активность.
Анодом является более химически активный металл в паре, а катодом - пассивный.
 Таким образом, по ряду напряжений легко определить какой металл является анодом, а какой катодом.
Например, оцинкованное железо. Это железо с цинковым покрытием.
Посмотрим, какое положение занимают эти металлы в ряду напряжений.
Цинк в ряду напряжений находится левее, значение его потенциала более отрицательно, чем у железа. Таким образом, цинк - более активный металл и в нашем случае он будет являться анодом, а железо, соответственно, катодом.
Если взять другой пример - луженое железо, то это железо, покрытое оловом.
Рассмотрим положение в ряду напряжений железа и олова. В этом случае анодом будет железо, т.к. располагается в ряду напряжений левее, а значит, химически активнее. На катоде будет олово.
Наряду с процессом поляризации протекает и процесс деполяризации. Это процесс повышения потенциала катода.

Наиболее распространенные деполяризаторы:
• растворенный в воде кислород
• молекулы воды
• катионы водорода
О том, какой деполяризатор будет определять протекание катодного процесса, можно судить по соотношению их концентраций. Нужно знать реакцию среды (кислая, щелочная, нейтральная) и на основании этого выбирать нужное уравнение для катода.

|